Obecnie laboratoryjna diagnostyka genetyczna wirusa SARS-CoV-2 oparta jest o metodę RT-PCR, a dokładnie jej odmianę – Real-Time Reverse Transcription PCR. W tej metodzie materiał genetyczny wirusa, RNA, jest przepisany na komplementarne DNA (tzw. cDNA) przez enzym – odwrotną transkryptazę, w połączeniu z etapem namnażania cDNA z wykorzystaniem drugiego enzymu – polimerazy. Mechanizm detekcji oparty jest najczęściej na sondach molekularnych lub barwniku fluorescencyjnym. Łącznie można założyć, że średni czas wykonania reakcji Real-Time RT-PCR w laboratorium na obecność patogenu jak wirus SARS-CoV-2, zajmuje 90 minut, a często nawet dłużej, w zależności od jakości użytych enzymów i sprawności urządzenia Real-Time PCR.
W technologii Real-Time RT-LAMP ta sama próbka może zostać zanalizowana w czasie krótszym niż 30 minut, z użyciem tego samego sprzętu laboratoryjnego.
Poniżej wyszczególnione produkty Genomtec dopuszczone do obrotu rynkowego (Unia Europejska – CE-IVD). Każdy produktu posiada listę dokumentów do pobrania (w przypadku autoryzacji do sprzedaży).
Test genetyczny Genomtec SARS-CoV-2 Duo Kit (nr kat. GA00B) wykrywa wszystkie znane warianty koronawirusa (brytyjski, południowoafrykański, brazylijski i z Bretanii).
Genomtec wprowadził także na rynek linię produktową Genomtec® SARS-CoV-2 EvaGreen® Direct, w której nie występuje standardowe laboratoryjne oczyszczanie materiału genetycznego. Zastępuje je proces lizy w połączeniu z oczyszczaniem dzięki wykorzystani specjalnego buforu oraz podwyższonej temperatury. Dzięki temu etap izolacji kwasu nukleinowego jest zastąpiony szybką i prostą procedurą pozwalającą zaoszczędzić czas i obniżyć całkowity koszt diagnostyki.
Dodatkowo do testu Genomtec® RT-LAMP-Direct oferujemy Zestaw do poboru i transportu próbki śliny.

Instrukcja wykorzystania w laboratorium pierwszego na świecie genetycznego testu diagnostycznego do wykrywania SARS-CoV-2 bezpośrednio z próbki śliny: Genomtec® SARS-Cov-2 EvaGreen® Direct-RT-LAMP CE-IVD Kit.
Następuje pobranie próbki śliny, wymazu z gardła lub noso-gardzieli.
Odpowiednio zabezpieczona próbka jest przekazana do laboratorium diagnostycznego (do 24 godzin).
Kwas nukleinowy RNA jest wyizolowany i oczyszczany z materiału biologicznego w sposób manualny lub automatyczny.
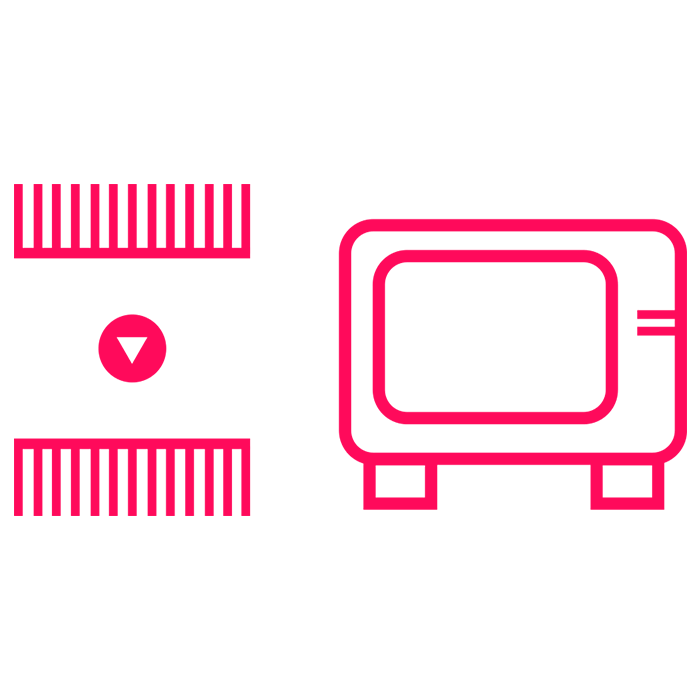
Oczyszczone RNA zostaje przepisane na cDNA z jednoczesnym namnożeniem w reakcji RT-LAMP.
Pozytywny wynik w próbce klinicznej można uzyskać już po 11 minutach – po przekroczeniu progu fluorescencji przez sygnał.

Pobranie śliny lub suchego wymazu z nosogardzieli lub gardła do odpowiedniego pojemnika transportowego (5 min.)

Transport materiału biologicznego (ślina lub suchy wymaz) do laboratorium diagnostycznego do 24 godzin

Zmieszanie odczynnika LysBuffer ze śliną lub suchym wymazem oraz podgrzanie mieszaniny przez 5 min. w 95 ͦC celem przygotowania lizatu. Proces przygotowania próbki śliny / suchego wymazu z użyciem odczynnika LysBuffer zajmuje 5 minut podczas podgrzewania w bloku grzejnym (bez czasu pipetowania)
Jednoczesna transkrypcja kwasu RNA do cDNA oraz namnażanie w technologii RT-LAMP (40 min.)
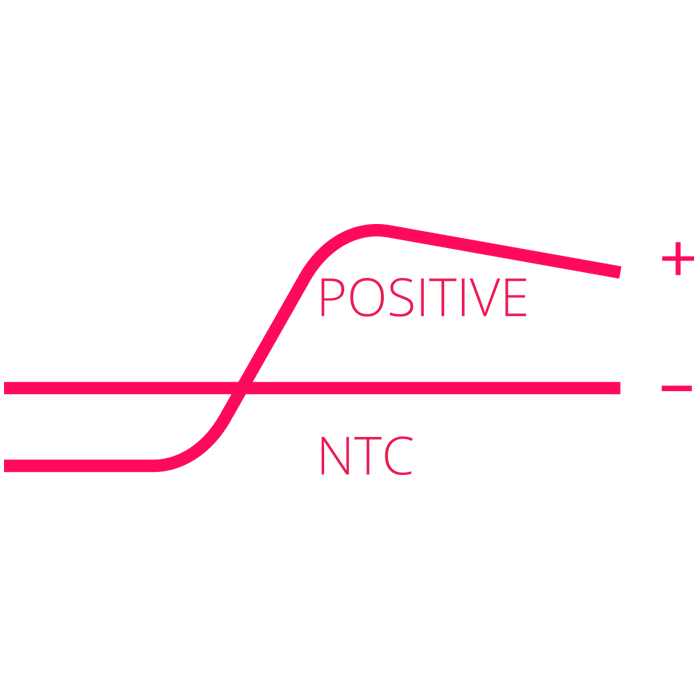
Wykrycie pozytywnych próbek klinicznych w rekordowym czasie nawet 20 min. – kiedy sygnał fluorescencji przekracza próg tła
Agencja Oceny Technologii Medycznych i Taryfikacji wydała aktualizację 2.0 zaleceń p.t. „Diagnostyka laboratoryjna SARS-CoV-2”.
Zalecenia sformułowane zostały przez Radę Naukową oraz Panel Ekspertów, na podstawie konsensusu eksperckiego, wynikającego z bieżącej sytuacji epidemiologicznej oraz przeglądu doniesień naukowych dla metod diagnostycznych SARS-CoV-2.
W opracowaniu tym ponownie wskazano, iż zaletą testów genetycznych jest potwierdzenie zakażenia we wczesnej fazie, przed wystąpieniem objawów klinicznych, gdy test antygenowy jest ujemny.
W zaleceniach dla diagnostyki molekularnej potwierdzono, że „szybkie testy genetyczne RT-PCR lub izotermiczne RT-LAMP” mogą być stosowane. Nadzór nad jakością tych badań pełni laboratorium wpisane na listę „Laboratoriów COVID” Ministerstwa Zdrowia.
Całość dokumentu dostępna do pobrania: Pobierz dokument PDF
| Nazwa dokumentu | Wersja | Opublikowano | |
|---|---|---|---|
| Karta produktu | PI00BPLrE | 2022-01-07 | Pobierz |
| Instrukcja użytkowania | IFU00BPLrE | 2022-01-07 | Pobierz |
| Ulotka informacyjna | MM00BrB | 2022-01-07 | Pobierz |
| Raport czułości testu | 2021-11-30 | Pobierz |
| Nazwa dokumentu | Wersja | Opublikowano | |
|---|---|---|---|
| Certyfikat Analizy | 0000C | 2020-12-16 | Pobierz |
| Certyfikat Analizy | 0000D | 2021-02-05 | Pobierz |
| Certyfikat Analizy | 0000E | 2021-03-04 | Pobierz |
| Certyfikat Analizy | 0000F | 2021-05-17 | Pobierz |
| Certyfikat Analizy | 0000G | 2021-06-09 | Pobierz |
| Certyfikat Analizy | 0000H | 2021-09-02 | Pobierz |
| Certyfikat Analizy | 0000I | 2021-12-03 | Pobierz |
| Certyfikat Analizy | 0000J | 2021-12-21 | Pobierz |
| Certyfikat Analizy | 0000K | 2022-02-02 | Pobierz |
| Certyfikat Analizy | 0000L | 2022-02-15 | Pobierz |
| Nazwa dokumentu | Wersja | Opublikowano | |
|---|---|---|---|
| Karta produktu | PI00CUKrE | 2022-01-07 | Pobierz |
| Instrukcja użytkowania | IFU00CUKrE | 2022-01-07 | Pobierz |
| Ulotka informacyjna | MM00CPLrA | 2021-06-10 | Pobierz |
| Raport czułości testu | 2021-11-30 | Pobierz |
| Nazwa dokumentu | Wersja | Opublikowano | |
|---|---|---|---|
| Ogólne Warunki Sprzedaży i Świadczenia Usług | 01.2020 | 2020-11-23 | Pobierz |