Aktualnie Genomtec rozwija swoją technologię w dwóch obszarach:
1. Mobilna platforma do diagnostyki genetycznej PoCT (Point-of-Care Testing) dla gabinetów lekarskich, przychodni, szpitali, aptek:
1.1. Genomtec® ID Analyzer.
1.2. Genomtec® ID Respiratory Panel 5-Plex.
1.2. Genomtec Tumor (wczesny etap).
2. Nowoczesne testy genetyczne RT-LAMP do wykorzystania w laboratoriach diagnostyki medycznej:
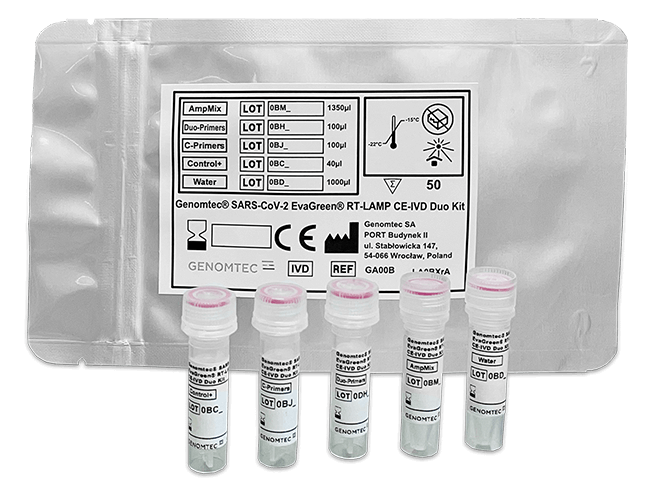
2.1. Genomtec® SARS-CoV-2 EvaGreen® RT-LAMP CE-IVD Duo-Kit.
2.2. Genomtec® SARS-Cov-2 EvaGreen® Direct-RT-LAMP CE-VD Kit .


Genomtec ID, to obecnie opracowywane flagowe rozwiązanie technologiczne Spółki, które zapewni pacjentom ultraszybką mobilną diagnostykę genetyczną przeprowadzaną w technologii SNAAT®. System Genomtec ID pozwala na przeprowadzenie procesu diagnostycznego w miejscach opieki nad pacjentem, takimi jak: przychodnie POZ, gabinety lekarskie, apteki szpitalne czy oddziały ratunkowe (SOR) , bez konieczności jego skomplikowanej oraz czasochłonnej obsługi w laboratorium przez wykwalifikowany personel.
Platforma składa się z analizatora oraz karty reakcyjnej ze zintegrowanymi testami genetycznymi oraz posiada zdolność analizy do pięciu celów genetycznych jednocześnie (z ang. multiplexing). SARS-CoV-2 znajdzie się na jednym z paneli diagnostycznych przeznaczonych do identyfikacji chorób układu oddechowego na Genomtec ID.
Obecnie diagnostyka molekularna wymaga od użytkownika umiejętności posługiwania się sprzętem diagnostycznym oraz wiedzy na temat właściwego przygotowania próbki. Metoda SNAAT® łączy mobilność z niesamowitą łatwością wykonania badania. Obsługę intuicyjnej i prostej platformy diagnostycznej jest w stanie wykonać personel służby zdrowia bez przeszkolenia laboratoryjnego – pielęgniarka, lekarz, ratownik medyczny.
Do 100%
Do 100%
Wystarczy nanieść kroplę materiału biologicznego, badanie nie wymaga wcześniejszego przygotowania próbki
Analizator mogą wykorzystywać m.in. lekarze rodzinni, pediatrzy, ginekolodzy, pielęgniarki, ratownicy medyczni
Efektywność cenowa pojedynczego badania jest porównywalna z innymi dostępnymi technologiami
Nawet 5 badań podczas 1 testu
W przyszłości analizatory dostarczać będą anonimowe informacje o globalnych ogniskach występowania poszczególnych chorób





Projekt Genomtec Tumor znajduje się obecnie na wczesnym etapie analiz nad rozwiązaniami bazującymi na technologii SNAAT® mającymi zastosowanie do szybkiej identyfikacji mutacji nowotworowych lub predysponujących do choroby nowotworowej, w ujęciu „diagnostyki towarzyszącej” (z ang. Companion Diagnostics, CDx). Technologia SNAAT® dostosowana zostanie do bliskiej pacjenta diagnostyki mutacji nowotworowych i pozwoli na szybkie wdrożenie leczenia spersonalizowanego. W sytuacji jej połączenia z biomarkerami białkowymi, istnieje możliwość stworzenia platformy diagnostycznej do badań przesiewowych i/ lub wysoko specyficznej identyfikacji antygenów w badaniach immunogenetycznych.
Wczesna faza tego projektu, szczególnie w porównaniu do Genomtec ID oraz testów laboratoryjnych powoduje, że jest to projekt, którego dalszy rozwój będzie uzależniony od sukcesu pozostałych projektów lub pozyskania partnera branżowego czy finansowania grantowego do dalszego rozwoju tego przedsięwzięcia.
Obecna wartość rynku molekularnej diagnostyki onkologicznej to ok 2,6 mld USD z planowanym wskaźnikiem wzrostu do 2024 r. na poziomie CAGR 18,46% i planowaną wartością na poziomie 5.12 mld USD. Warto również zauważyć, że aktualny czas oczekiwania na wyniki testu genu BRCA1&2 w Polsce to pomiędzy 2 a 4 tygodnie, gdzie Genomtec Tumor, mógłby go skrócić do kilku lub kilkunastu godzin.
W ramach tego projektu Genomtec opracował i wprowadził na rynek innowacyjne zestawy diagnostyki laboratoryjnej służące do przeprowadzenia testów jakościowych wykrywających RNA koronawirusa SARS-CoV-2 w różnych próbkach biologicznych u pacjentów podejrzanych o chorobę COVID-19, a przyszłościowo również inne patogeny. Testy zawierają zoptymalizowaną kompozycję odczynników, specyficzne enzymy oraz chronione własnością intelektualną startery reakcji LAMP, a sama reakcja amplifikacji RNA jest przeprowadzana w technice izotermalnej RT-LAMP lub LAMP. Gwarantuje to wykrycie sygnału dla pozytywnych próbek klinicznych już po 11 minutach dla SARS-CoV-2 w procesie amplifikacji oraz jego kompatybilność ze standardowymi termocyklerami Real-Time PCR z zielonym (FAM) kanałem odczytu fluorescencji.
Genomtec posiada obecnie w sprzedaży dwa zarejestrowane testy dwugenowe: Genomtec® SARS-CoV-2 EvaGreen® RT-LAMP CE-IVD Duo-Kit, który został dopuszczony do sprzedaży w Europie oraz może być dystrybuowany na innych kontynentach oraz Genomtec® SARS-Cov-2 EvaGreen® Direct-RT-LAMP CE-IVD Kit, który umożliwia przeprowadzenie badania w kierunku identyfikacji zakażenia SARS-CoV-2 bezpośrednio ze śliny pacjenta. Innowacyjny test zapewnia pacjentom większy komfort, gdyż nie muszą być poddawani procedurze pobrania wymazu np. z nosogardzieli. Możliwość badania bezpośrednio ze śliny, zmniejsza również ryzyko ekspozycji na wirusa dla personelu pobierającego próbkę i nie wymaga specjalistycznych umiejętności. Dzięki testowi RT-LAMP Direct Kit odczytanie wyniku testu od momentu otrzymania próbki śliny przez laboratorium, jest możliwe już po kilkudziesięciu minutach.
Test Genomtec® SARS-Cov-2 EvaGreen® Direct-RT-LAMP CE-IVD Kit został zarejestrowany do sprzedaży w Unii Europejskiej.
Obecnie laboratoryjna diagnostyka genetyczna wirusa SARS-CoV-2 oparta jest o metodę RT-PCR, a dokładnie jej odmianę – Real-Time Reverse Transcription PCR. W tej metodzie materiał genetyczny wirusa, RNA, jest przepisany na komplementarne DNA (tzw. cDNA) przez enzym – odwrotną transkryptazę, w połączeniu z etapem namnażania cDNA z wykorzystaniem drugiego enzymu – polimerazy. Mechanizm detekcji oparty jest najczęściej na sondach molekularnych lub barwniku fluorescencyjnym. Łącznie można założyć, że średni czas wykonania reakcji Real-Time RT-PCR w laboratorium na obecność patogenu jak wirus SARS-CoV-2, zajmuje 90 minut, a często nawet dłużej, w zależności od jakości użytych enzymów i sprawności urządzenia Real-Time PCR. W technologii Real-Time RT-LAMP ta sama próbka może zostać zanalizowana w czasie krótszym niż 30 minut, z użyciem tego samego sprzętu laboratoryjnego.
Korzyści dla laboratoriów testujących za pomocą Genomtec® RT-LAMP Duo Kit:
Film instruktażowy pokazujący wszystkie etapy użycia zestawu molekularnego Genomtec® Duo-Kit do wykrywania obecności wirusa SARS-CoV-2 w laboratorium.
Następuje pobranie próbki śliny, wymazu z gardła lub noso-gardzieli
Odpowiednio zabezpieczona próbka jest przekazana do laboratorium diagnostycznego
(do 24 godzin)
Kwas nukleinowy RNA jest wyizolowany i oczyszczany z materiału biologicznego w sposób manualny lub automatyczny
Oczyszczone RNA zostaje przepisane na cDNA z jednoczesnym namnożeniem w reakcji RT-LAMP
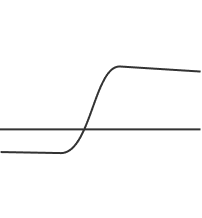
Pozytywny wynik w próbce klinicznej można uzyskać już po 11 minutach – po przekroczeniu progu fluorescencji przez sygnał
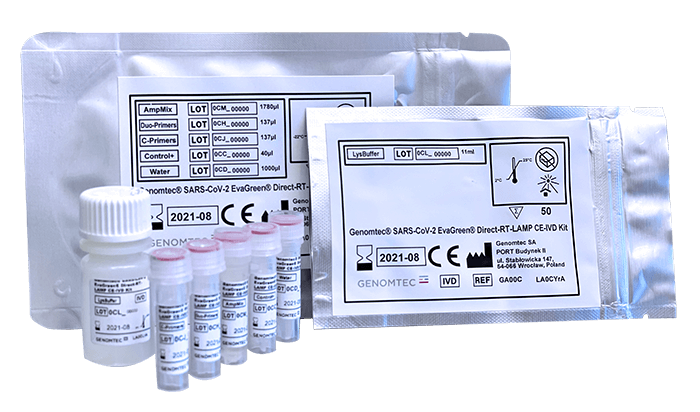
Genomtec® SARS-CoV-2 Zestaw EvaGreen® Direct-RT-LAMP CE-IVD jest dopuszczonym do obrotu w Unii Europejskiej diagnostycznym testem izotermicznej amplifikacji z jednoczesną odwrotną transkrypcją w czasie rzeczywistym (RT-LAMP) do jakościowego wykrywania kwasu RNA w dwóch genach wirusa SARS-CoV-2, z uproszczonym etapem przygotowania próbki biologicznej.* Cechuje go szybkie przygotowanie wzbogaconych o kwas RNA lizatów z jednoczesną transkrypcją RNA i amplifikacją cDNA przy użyciu standardowego instrumentu Real-Time PCR (wykrywanie w kanale FAM), z czasem ok. 50 minut od próbki do rezultatu, z czego sam etap amplifikacji zajmuje 40 minut.
BADANIE KLINICZNE
93,75% czułości diagnostycznej oraz 100% specyficzności diagnostycznej potwierdzone w badaniu porównawczym do referencyjnego testu Real-Time RT-PCR CE-IVD.
Przetestowane typy próbek obejmują ślinę oraz suche wymazy z nosogardzieli i gardła. Walidację kliniczną przeprowadzono na próbkach śliny (jak w Instrukcji Użytkowania, punkt 9.5; postępowanie z próbką suchego wymazu jest opisane w Punkcie 6.2 Instrukcji).
Proces przygotowania próbki śliny / suchego wymazu z użyciem odczynnika LysBuffer zajmuje 5 minut podczas podgrzewania w bloku grzejnym (bez czasu pipetowania).
ROZPOZNAWALNE SZCZEPY WIRUSA
Zestaw diagnostyczny Genomtec® Direct-RT-LAMP Kit wykrywa pierwotny szczep wirusa SARS-CoV-2 oraz jego następujące warianty z udokumentowanymi mutacjami:
EPI_ISL_723044 / wariant B.1.1.7 / Alfa (klasyfikacja WHO)
EPI_ISL_825139 / wariant B. 1.351 / Beta (klasyfikacja WHO)
EPI_ISL_792680 / wariant P.1 / Gamma (klasyfikacja WHO)
EPI_ISL_2650470 / wariant B.1.617.2 / Delta (klasyfikacja WHO)
EPI_ISL_2631197 / wariant B.1.427 / B.1.429 / Epsilon (klasyfikacja WHO)
EPI_ISL_2614193 / wariant P.2 / Zeta (klasyfikacja WHO)
EPI_ISL_1563854 / wariant B.1.525 / Eta (klasyfikacja WHO)
EPI_ISL_1122452 / wariant P.3 (version: 2021-04-01) / Theta (klasyfikacja WHO)
EPI_ISL_2647531 / wariant B.1.526 / Iota (klasyfikacja WHO)
EPI_ISL_1415353 / wariant B.1.617.1 / Kappa (klasyfikacja WHO)
EPI_ISL_2536799 / wariant C.37 / Lambda (klasyfikacja WHO)
EPI_ISL_6811664 / wariant B.1.621 / Mu (klasyfikacja WHO)
EPI_ISL_6590782 / wariant B.1.1.529 / Omicron (klasyfikacja WHO)
EPI_ISL_1259297 / wariant Breton (hCoV-19/France/ BREIPP04233/2021).
Test Genomtec® RT-LAMP oferuje mnóstwo korzyści:
Dzięki użyciu Genomtec® Direct RT-LAMP wprowadzamy nową jakość testowania na obecność wirusa SARS-CoV-2.
 |
|
Dla pacjenta nasz test oznacza:
|
 |
|
Dla personelu medycznego nasz test oznacza:
|
 |
|
Dla laboratoriów nasz test oznacza:
|
 |
|
Dla systemu opieki zdrowotnej nasz test oznacza:
|

Pobranie śliny lub suchego wymazu z nosogardzieli lub gardła do odpowiedniego pojemnika transportowego (5 min.)

Transport materiału biologicznego (ślina lub suchy wymaz) do laboratorium diagnostycznego do 24 godzin

Zmieszanie odczynnika LysBuffer ze śliną lub suchym wymazem oraz podgrzanie mieszaniny przez 5 min. w 95 ͦC celem przygotowania lizatu. Proces przygotowania próbki śliny / suchego wymazu z użyciem odczynnika LysBuffer zajmuje 5 minut podczas podgrzewania w bloku grzejnym (bez czasu pipetowania)
Jednoczesna transkrypcja kwasu RNA do cDNA oraz namnażanie w technologii RT-LAMP (40 min.)
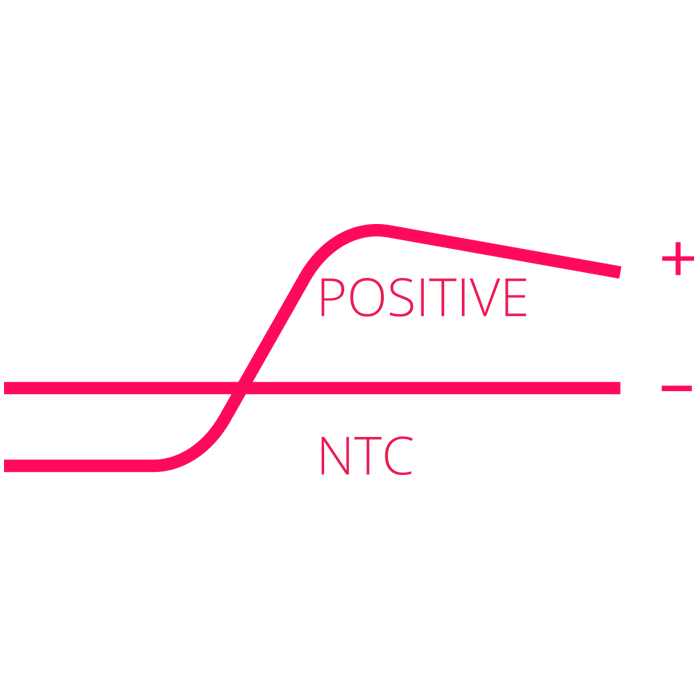
Wykrycie pozytywnych próbek klinicznych w rekordowym czasie nawet 20 min. – kiedy sygnał fluorescencji przekracza próg tła
Instrukcja wykorzystania w laboratorium pierwszego na świecie genetycznego testu diagnostycznego do wykrywania SARS-CoV-2 bezpośrednio z próbki śliny: Genomtec® SARS-Cov-2 EvaGreen® Direct-RT-LAMP CE-IVD Kit.
| Oznakowanie produktu: | GC00A |
|---|---|
| Nazwa produktu: | Zestaw do poboru i transportu śliny |
| Części składowe: |
|
| Użyte materiały: | PP (polipropylen) |
| Metoda sterylizacji: | Sterylizacja radiacyjna |
| Opakowanie: | Indywidualne opakowanie papierowo-foliowe |
| Ilość: | Pojedynczy produkt w opakowaniu |
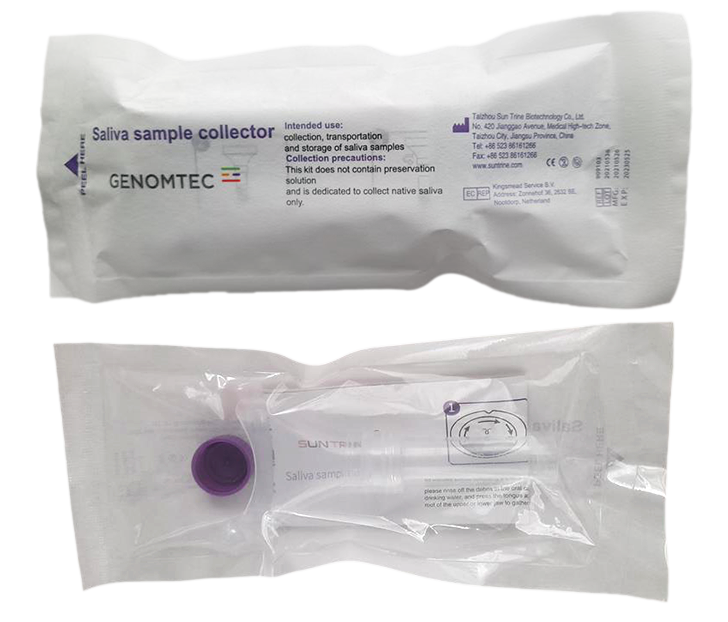
Produkt ten jest przeznaczony do pobierania, przechowywania i transportu próbki natywnej śliny do celów diagnostyki klinicznej i nie zawiera żadnego roztworu stabilizującego kwasy nukleinowe. Produkt jest wolny od DNaz/RNaz i pirogenów oraz jest sterylizowany radiacyjnie. Jest kompatybilny z zestawem diagnostycznym Genomtec® SARS-CoV-2 EvaGreen® Direct-RT-LAMP CE-IVD Kit (nr kat.: GA00C).
Składa się z trzech części:
Zestaw do poboru i transportu śliny posiada oznakowanie CE-IVD. Informacje na temat procesu pobierania śliny, warunków przechowywania i przedstawiciela producenta w UE można znaleźć w Instrukcji użytkowania (IFU) dostępnej w sekcji Wsparcie oraz Dla Laboratoriów.
Każdy produkt posiada listę dokumentów do pobrania (w przypadku autoryzacji do sprzedaży).